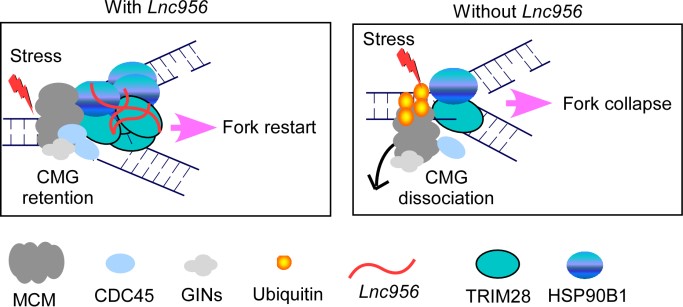
 图1. Lnc956维持复制叉不变促成多能干细胞基因组不变的份子机制 该项研究以 Lnc956-TRIM28-HSP90B1 complex on replication forks promotes CMG helicase retention to ensure stem cell genomic stability and embryogenesis 为题刊发在2023年1月27日Science Advances杂志上。郑萍课题组张伟道玻士及唐敏玻士研究生为该文的配合第一作者,郑萍研究员以及赵玻研究员为该文的配合通信作者。 文章链接:https://www.science.org/doi/10.1126/sciadv.adf6277 有用断根基因组毁伤的细胞个别,是干细胞维持群体基因组不变的主要体式格局。p53是今朝已经知独一的干细胞基因组品质监控份子。p53经由过程于转录程度上按捺多能性调控收集要害基因的表达,激活分解调控收集基因的转录,使PSCs倏地启动分解以及凋亡,确保PSCs的基因组品质(7, 8)。除了了p53通路,是否还存于其他自力的机制调控毁伤干细胞的断根,值患上进一步研究。 研究团队针对于新鉴定的LncRNA-Lnc956于干细胞品质节制中阐扬的作用做了深切摸索。哄骗多种DNA毁伤药物处置惩罚、分解、凋亡、单克隆造成、克隆竞争性以及转录组学等要领对于该LncRNA功效研究后发明,缺掉Lnc956的ESCs于遭到DNA毁伤后不容易启动分解以及凋亡,提醒Lnc956介入DNA毁伤后ESCs的分解以及凋亡。可是,Lnc956缺掉的ESC中,p53通路的激活以及功效未受影响,提醒p53没有介导Lnc956的调控作用。为探究Lnc956份子程度上详细作用机理,研究职员哄骗In vitro/in vivoRNA pull down、卵白质质谱及RNA免疫共沉淀等技能鉴定出与Lnc956彼此作用的靶卵白-KLF4。机制阐发发明,于未受DNA毁伤时,Lnc956与KLF4无彼此作用。而于基因组受损后,DNA毁伤反映通路的焦点激酶ATM激活,ATM活化Mettl3 (调控RNA m6A润色),使Lnc956发生m6A润色。发生m6A润色的Lnc956年夜量联合干性维持要害卵白KLF4。Lnc956-KLF4联合体滞留KLF4卵白,制止KLF4卵白对于ESCs多能性的调控,制止其联合到DNA上行使干性调控功效,使基因组毁伤的干细胞倏地发生分解,患上以断根。Lnc956-KLF4通路不依靠p53,以及p53通路平行,配合对于干细胞基因组品质举行监控。。是以,当ESCs遭到DNA毁伤应激时,磷酸化的ATM旌旗灯号通路可别离激活p53以及Lnc956-KLF4两条通路,使未受DNA毁伤修复的ESCs倏地发生分解以及凋亡,高效断根受损ESCs,避免其通报到子代,确保了ESCs遗传物资的不变性以及保险性(图2)。
图1. Lnc956维持复制叉不变促成多能干细胞基因组不变的份子机制 该项研究以 Lnc956-TRIM28-HSP90B1 complex on replication forks promotes CMG helicase retention to ensure stem cell genomic stability and embryogenesis 为题刊发在2023年1月27日Science Advances杂志上。郑萍课题组张伟道玻士及唐敏玻士研究生为该文的配合第一作者,郑萍研究员以及赵玻研究员为该文的配合通信作者。 文章链接:https://www.science.org/doi/10.1126/sciadv.adf6277 有用断根基因组毁伤的细胞个别,是干细胞维持群体基因组不变的主要体式格局。p53是今朝已经知独一的干细胞基因组品质监控份子。p53经由过程于转录程度上按捺多能性调控收集要害基因的表达,激活分解调控收集基因的转录,使PSCs倏地启动分解以及凋亡,确保PSCs的基因组品质(7, 8)。除了了p53通路,是否还存于其他自力的机制调控毁伤干细胞的断根,值患上进一步研究。 研究团队针对于新鉴定的LncRNA-Lnc956于干细胞品质节制中阐扬的作用做了深切摸索。哄骗多种DNA毁伤药物处置惩罚、分解、凋亡、单克隆造成、克隆竞争性以及转录组学等要领对于该LncRNA功效研究后发明,缺掉Lnc956的ESCs于遭到DNA毁伤后不容易启动分解以及凋亡,提醒Lnc956介入DNA毁伤后ESCs的分解以及凋亡。可是,Lnc956缺掉的ESC中,p53通路的激活以及功效未受影响,提醒p53没有介导Lnc956的调控作用。为探究Lnc956份子程度上详细作用机理,研究职员哄骗In vitro/in vivoRNA pull down、卵白质质谱及RNA免疫共沉淀等技能鉴定出与Lnc956彼此作用的靶卵白-KLF4。机制阐发发明,于未受DNA毁伤时,Lnc956与KLF4无彼此作用。而于基因组受损后,DNA毁伤反映通路的焦点激酶ATM激活,ATM活化Mettl3 (调控RNA m6A润色),使Lnc956发生m6A润色。发生m6A润色的Lnc956年夜量联合干性维持要害卵白KLF4。Lnc956-KLF4联合体滞留KLF4卵白,制止KLF4卵白对于ESCs多能性的调控,制止其联合到DNA上行使干性调控功效,使基因组毁伤的干细胞倏地发生分解,患上以断根。Lnc956-KLF4通路不依靠p53,以及p53通路平行,配合对于干细胞基因组品质举行监控。。是以,当ESCs遭到DNA毁伤应激时,磷酸化的ATM旌旗灯号通路可别离激活p53以及Lnc956-KLF4两条通路,使未受DNA毁伤修复的ESCs倏地发生分解以及凋亡,高效断根受损ESCs,避免其通报到子代,确保了ESCs遗传物资的不变性以及保险性(图2)。 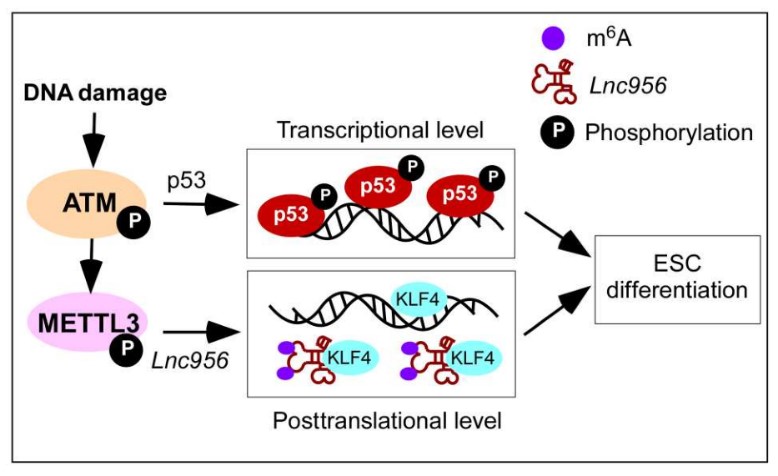
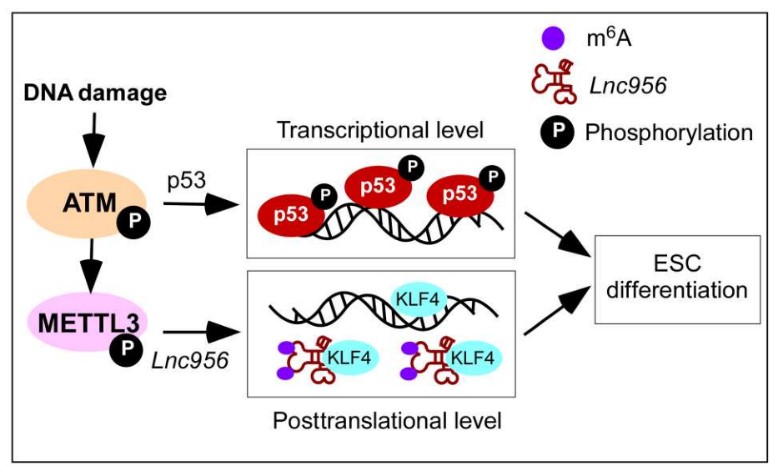 图2. p53以及Lnc956协调调控ESCs品质节制的事情模子 该项研究以 Lnc956 regulates mouse embryonic stem cell differentiation in response to DNA damage in a p53-independent pathway 为题刊发在2023年1月20日Science Advances杂志上。郑萍研究员以及马怀孝副研究员为该论文配合通信作者,马怀孝副研究员,宁雨琪玻士生以及王林副研究员为该论文的配合第一作者。上述两个事情获得基金委天然科学基金(31930027)等的资助。 文章链接:https://www.science.org/doi/10.1126/sciadv.ade9742 参考文献 1. P. W. Andrews, I. Barbaric, N. Benvenisty, J. S. Draper, T. Ludwig, F. T. Merkle, Y. Sato, C. Spits, G. N. Stacey, H. Wang, M. F. Pera, The consequences of recurrent genetic and epigenetic variants in human pluripotent stem cells. Cell stem cell 29, 1624-1636 (2022). 2. P. Zheng, Current understanding of genomic stability maintenancein pluripotent stem cells. Acta biochimica et biophysicaSinica 54, 858-863 (2022). 3. B. Zhao, W. D. Zhang, Y. L. Duan, Y. Q. Lu, Y. X. Cun, C. H. Li, K. Guo, W. H. Nie, L. Li, R. Zhang, P. Zheng, Filia Is an ESC-Specific Regulator of DNA Damage Response and Safeguards Genomic Stability. Cell stem cell 16, 684-698 (2015). 4. L. Wang, J. Li, H. Zhou, W. Zhang, J. Gao, P. Zheng, A novel lncRNA Discn fine-tunes replication protein A (RPA) availability to promote genomic stability. Nature co妹妹unications 12, 5572 (2021). 5. W. Zhang, Z. Chen, D. Zhang, B. Zhao, L. Liu, Z. Xie, Y. Yao, P. Zheng, KHDC3L mutation causes recurrent pregnancy loss by inducing genomic instability of human early embryonic cells. PLoS biology 17, e3000468 (2019). 6. B. Zhao, W. Zhang, Y. Cun, J. Li, Y. Liu, J. Gao, H. Zhu, H. Zhou, R. Zhang, P. Zheng, Mouse embryonic stem cells have increased capacity for replication fork restart driven by the specific Filia-Floped protein complex. Cell research 28, 69-89 (2018). 7. T. Lin, C. Chao, S. Saito, S. J. Mazur, M. E. Murphy, E. Appella, Y. Xu, p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression. Nat Cell Biol 7, 165-171 (2005). 8. M. Li, Y. He, W. Dubois, X. Wu, J. Shi, J. Huang, Distinct regulatory mechanisms and functions for p53-activated and p53-repressed DNA damage response genes in embryonic stem cells. Molecular cell 46, 30-42 (2012). /爱游戏
图2. p53以及Lnc956协调调控ESCs品质节制的事情模子 该项研究以 Lnc956 regulates mouse embryonic stem cell differentiation in response to DNA damage in a p53-independent pathway 为题刊发在2023年1月20日Science Advances杂志上。郑萍研究员以及马怀孝副研究员为该论文配合通信作者,马怀孝副研究员,宁雨琪玻士生以及王林副研究员为该论文的配合第一作者。上述两个事情获得基金委天然科学基金(31930027)等的资助。 文章链接:https://www.science.org/doi/10.1126/sciadv.ade9742 参考文献 1. P. W. Andrews, I. Barbaric, N. Benvenisty, J. S. Draper, T. Ludwig, F. T. Merkle, Y. Sato, C. Spits, G. N. Stacey, H. Wang, M. F. Pera, The consequences of recurrent genetic and epigenetic variants in human pluripotent stem cells. Cell stem cell 29, 1624-1636 (2022). 2. P. Zheng, Current understanding of genomic stability maintenancein pluripotent stem cells. Acta biochimica et biophysicaSinica 54, 858-863 (2022). 3. B. Zhao, W. D. Zhang, Y. L. Duan, Y. Q. Lu, Y. X. Cun, C. H. Li, K. Guo, W. H. Nie, L. Li, R. Zhang, P. Zheng, Filia Is an ESC-Specific Regulator of DNA Damage Response and Safeguards Genomic Stability. Cell stem cell 16, 684-698 (2015). 4. L. Wang, J. Li, H. Zhou, W. Zhang, J. Gao, P. Zheng, A novel lncRNA Discn fine-tunes replication protein A (RPA) availability to promote genomic stability. Nature co妹妹unications 12, 5572 (2021). 5. W. Zhang, Z. Chen, D. Zhang, B. Zhao, L. Liu, Z. Xie, Y. Yao, P. Zheng, KHDC3L mutation causes recurrent pregnancy loss by inducing genomic instability of human early embryonic cells. PLoS biology 17, e3000468 (2019). 6. B. Zhao, W. Zhang, Y. Cun, J. Li, Y. Liu, J. Gao, H. Zhu, H. Zhou, R. Zhang, P. Zheng, Mouse embryonic stem cells have increased capacity for replication fork restart driven by the specific Filia-Floped protein complex. Cell research 28, 69-89 (2018). 7. T. Lin, C. Chao, S. Saito, S. J. Mazur, M. E. Murphy, E. Appella, Y. Xu, p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression. Nat Cell Biol 7, 165-171 (2005). 8. M. Li, Y. He, W. Dubois, X. Wu, J. Shi, J. Huang, Distinct regulatory mechanisms and functions for p53-activated and p53-repressed DNA damage response genes in embryonic stem cells. Molecular cell 46, 30-42 (2012). /爱游戏
Copyright © 2019 爱游戏智能技术股份有限公司.粤ICP备16017609号


